
技術文章
 更新時間:2025-08-26
更新時間:2025-08-26 點擊次數:238
點擊次數:238
在人類與癌癥的漫長斗爭中,手術、化療和放療長期占據主導地位。然而,這些傳統方法往往伴隨著巨大的副作用,且對晚期或轉移性癌癥的效果有限。直到21世紀初,免疫治療的出現改變了這一局面,而程序性死亡受體1(Programmed Cell Death Protein 1, PD-1) 作為免疫檢查點的關鍵分子,一躍成為癌癥治療領域的明星靶點。PD-1抑制劑的成功不僅為無數患者帶來了新生,還開創了“免疫檢查點阻斷"這一全新治療范式。本文將從PD-1的生物學功能、作用機制、臨床應用、當前挑戰及未來方向等方面,全面探討這一革命性靶點如何重塑現代癌癥治療格局。
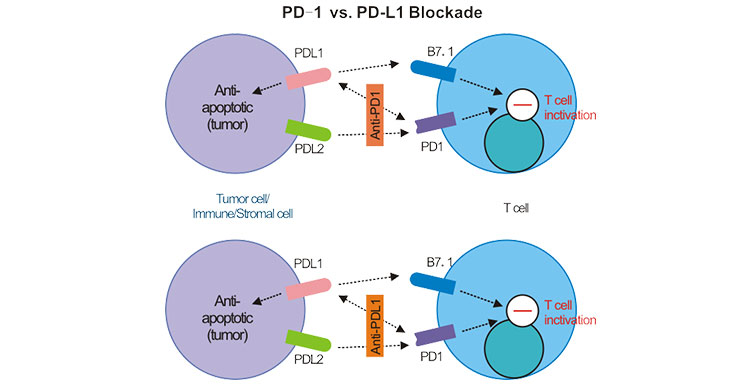
PD-1是一種主要表達于活化T細胞、B細胞和自然殺傷(NK)細胞表面的免疫檢查點蛋白,屬于CD28超家族成員。其名稱“程序性死亡受體"可能容易讓人誤解,因為它并非直接導致細胞死亡,而是通過傳遞抑制性信號,調節免疫反應的強度和持續時間,防止過度免疫激活導致的自身免疫損傷。換句話說,PD-1是免疫系統的一種“剎車"機制,確保免疫反應在清除病原體或異常細胞的同時,不傷害正常組織。
PD-1的功能主要通過與其配體PD-L1(Programmed Death-Ligand 1)和PD-L2的結合來實現。正常情況下,當T細胞被激活并攻擊外來病原或癌細胞時,PD-1的表達會上調。一旦PD-1與PD-L1/PD-L2結合,便會啟動下游信號通路,抑制T細胞的增殖、細胞因子產生和殺傷功能,從而避免免疫反應失控。然而,許多狡猾的癌細胞利用了這一機制:它們通過高表達PD-L1,主動與T細胞表面的PD-1結合,從而“欺騙"免疫系統,逃避免疫監視和攻擊。這種腫瘤微環境中的免疫逃逸是癌癥發生和發展的重要機制之一。
基于這一原理,科學家開發了PD-1抑制劑(如帕博利珠單抗、納武利尤單抗)和PD-L1抑制劑(如阿特珠單抗)。這些藥物通過阻斷PD-1與PD-L1的結合,解除腫瘤對免疫細胞的抑制,重新激活T細胞對癌細胞的殺傷能力。這種策略被稱為“免疫檢查點阻斷",其核心思想是釋放免疫系統的天然抗癌潛力,而非直接攻擊腫瘤細胞。
自2014年PD-1抑制劑納武利尤單抗(Opdivo)和帕博利珠單抗(Keytruda)獲批以來,免疫檢查點抑制劑已改變了多種癌癥的治療標準。截至目前,PD-1/PD-L1抑制劑已在全球獲批用于治療超過20種癌癥類型,包括黑色素瘤、非小細胞肺癌、肝癌、胃癌、腎癌、霍奇金淋巴瘤等。此外,這些藥物在某些具有特定生物標志物(如微衛星不穩定性高/MSI-H或腫瘤突變負荷高/TMB-H)的實體瘤中表現出顯著療效,成為“不限癌種"治療的重要突破。
在臨床應用中,PD-1抑制劑的使用通常需要考慮多個因素:
癌癥類型和分期:例如,在晚期黑色素瘤和非小細胞肺癌中,PD-1抑制劑已成為一線或二線標準治療選項,顯著延長了患者的總生存期。
生物標志物檢測:PD-L1表達水平、MSI狀態和TMB是預測療效的重要指標。例如,帕博利珠單抗在PD-L1高表達的非小細胞肺癌患者中療效尤為顯著。
聯合治療策略:為了進一步提高響應率,PD-1抑制劑常與化療、靶向治療、放療或其他免疫治療(如CTLA-4抑制劑)聯合使用。例如,“化療+免疫"組合在肺癌和三陰性乳腺癌中顯示出協同增效作用。
盡管PD-1抑制劑取得了巨大成功,但并非所有患者都能從中受益。總體而言,僅約20%-30%的患者對單藥治療有持續響應,其余患者可能出現原發性或繼發性耐藥。因此,如何精準篩選優勢人群、優化治療策略仍是當前研究的重點。
盡管PD-1抑制劑為代表的免疫治療帶來了革命性進步,但其臨床應用仍面臨兩大核心挑戰:耐藥性和免疫相關不良事件(irAEs)。
耐藥性問題是限制PD-1抑制劑療效的主要障礙。耐藥機制復雜多樣,包括:
腫瘤內在因素:如IFN-γ信號通路突變、抗原呈遞機制缺陷(如B2M基因突變)、或替代免疫檢查點(如TIM-3、LAG-3)的上調。
腫瘤微環境因素:如調節性T細胞(Tregs)、髓源性抑制細胞(MDSCs)等免疫抑制細胞的浸潤,或細胞外基質形成的物理屏障。
宿主因素:如腸道微生物組組成影響免疫治療響應,某些菌群(如Akkermansia muciniphila)可能增強療效。
為了克服耐藥,研究人員正在探索多種策略:
聯合治療:如PD-1抑制劑與CTLA-4抑制劑、VEGF抑制劑或PARP抑制劑聯用。
新型免疫調節劑:針對TIM-3、LAG-3、TIGIT等新興檢查點的抑制劑正在臨床試驗中。
個性化疫苗和細胞治療:如基于腫瘤新抗原的疫苗或T細胞受體工程化T細胞(TCR-T)療法。
免疫相關不良事件(irAEs) 是另一重大挑戰。由于PD-1抑制劑激活的免疫反應可能攻擊正常組織,導致諸如皮炎、結腸炎、肺炎、肝炎甚至內分泌疾病等副作用。大多數irAEs為輕度至中度,可通過糖皮質激素等免疫抑制劑控制,但嚴重時可能危及生命。因此,臨床管理需密切監測、早期診斷和及時干預。此外,研究發現irAEs的發生可能與療效正相關,提示免疫激活的雙面性。
PD-1研究的未來方向主要集中在個性化醫療、新型藥物開發和機制深入探索三個方面。
首先,生物標志物驅動的個性化治療將是重點。除了現有的PD-L1、MSI和TMB,研究人員正在尋找更精準的預測指標,如血液中的循環腫瘤DNA(ctDNA)動態變化、T細胞受體(TCR)克隆多樣性、以及腫瘤免疫微環境的時空異質性。人工智能和多組學技術的結合有望實現更精準的患者分層和療效預測。
其次,下一代免疫檢查點抑制劑正在蓬勃發展。除了針對多個檢查點的雙特異性抗體(如PD-1/CTLA-4雙抗)外,新型藥物形式如小分子抑制劑、細胞因子融合蛋白、以及靶向免疫代謝通路(如IDO、腺苷)的藥物也在研發中。這些藥物可能改善耐藥問題并擴大受益人群。
第三,聯合策略的優化將是臨床轉化的關鍵。例如,放療與PD-1抑制劑的聯合可通過“遠隔效應"激活全身免疫反應;溶瘤病毒可通過裂解腫瘤細胞釋放抗原,增強免疫細胞浸潤;表觀遺傳藥物(如HDAC抑制劑)可逆轉腫瘤免疫抑制微環境。
最后,基礎研究的深化將揭示PD-1信號通路的全新層面。例如,近期研究發現PD-1不僅表達于T細胞,還存在于耗竭性NK細胞、甚至某些腫瘤細胞上,提示其功能可能比已知的更為復雜。此外,腸道微生物組調控免疫治療響應的機制正成為熱門領域,菌群移植(FMT)或益生菌干預可能成為輔助治療新策略。
程序性死亡受體1(PD-1)的發現和靶向藥物的開發,無疑是癌癥治療的一座里程碑。它不僅為晚期患者提供了長期生存的可能,更推動了免疫學、腫瘤學和藥物研發領域的跨越式發展。然而,PD-1抑制劑并非萬能神藥,其耐藥性、毒性和響應率限制仍是亟待解決的難題。未來,通過多學科合作、技術創新和精準醫療的深入推進,我們有理由相信,PD-1研究將繼續帶著癌癥免疫治療走向更高效、更安全、更個性化的新時代。正如諾貝爾生理學或醫學獎得主本庶佑所言:“免疫治療的故事才剛剛開始",而PD-1無疑是這一故事中精彩的篇章之一。
杭州斯達特 志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
程序性死亡受體1(PD-1):癌癥免疫治療的革命性靶點