
技術(shù)文章
 更新時間:2025-08-25
更新時間:2025-08-25 點擊次數(shù):255
點擊次數(shù):255

L-乳酸被認為是信號傳導和代謝平衡的關(guān)鍵分子。乳酰化,一種由L-乳酸衍生的蛋白質(zhì)翻譯后修飾(PTM),在多種蛋白質(zhì)上普遍存在,并在細胞過程中發(fā)揮重要作用。25年6月由浙江大學張龍教授團隊發(fā)表在《STAR Protocol》上的《Protocol for label-free quantitative lysine lactylproteome profiling》介紹了一種全面分析乳酰化蛋白質(zhì)組并進行無標簽定量的方法。作者詳細介紹了細胞制備、蛋白質(zhì)提取、消化、肽脫鹽及乳酰肽富集的步驟。此外,還概述了液相色譜-串聯(lián)質(zhì)譜(LC-MS/MS)分析的參數(shù)設(shè)置。
方案概覽:
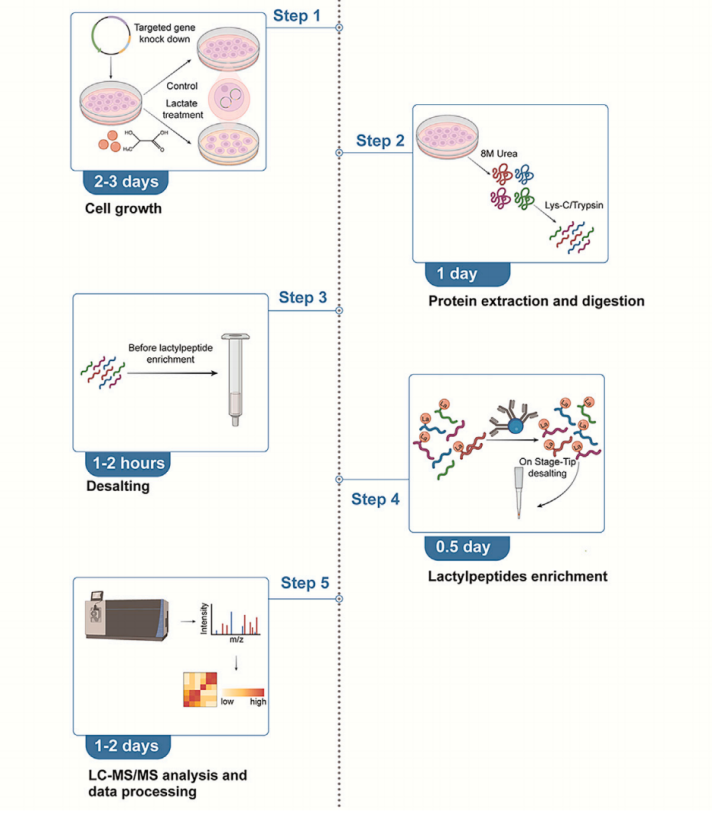
準備工作:
該方案描述了在AARS1和AARS2(AARS1/2)敲低、過表達以及野生型細胞中進行乳酸化分析的定量方法。
實驗時需準備以下材料:
編碼AARS1/2的哺乳動物細胞表達載體及針對AARS1/2的siRNA
在含有10%(體積比)胎牛血清、100 mg/mL青霉素和鏈霉素的DMEM培養(yǎng)基中培養(yǎng)HEK293T細胞和HeLa細胞
將細胞系置于37C、5%二氧化碳的濕潤培養(yǎng)箱中培養(yǎng)。定期檢測是否有支原體細胞污染
至少每48小時更換一次細胞培養(yǎng)基,吸出一半舊培養(yǎng)基(注意不要破壞細胞spheroids結(jié)構(gòu)),并補充等量的新鮮培養(yǎng)基
校準LC-MS設(shè)備,并運行質(zhì)量控制樣本,如HeLa細胞裂解物標準品,以確保LC-MS/MS性能符合預(yù)期
分步方法詳解
細胞培養(yǎng)
時間:2天
本部分介紹了用于轉(zhuǎn)染的 HEK293T 細胞培養(yǎng)物的制備
37℃水浴中預(yù)熱 DMEM、PBS 和胰蛋白酶-EDT
使用10 cm 培養(yǎng)皿培養(yǎng) HEK293T 細胞,在培養(yǎng)條件為5% CO2和 37℃,使用DMEM 培養(yǎng)基培養(yǎng)直至達到 80%–90% 細胞密度
吸出生長培養(yǎng)基并用 2 mL 無菌 PBS 輕輕清洗細胞兩次
吸出 PBS,加入 1 mL 胰蛋白酶-EDTA 分離細胞,37℃孵育直至細胞分離(約 30 秒
為了中和胰蛋白酶-EDTA,添加 2 mL 生長培養(yǎng)基并通過移液重新懸浮,直到所有細胞從培養(yǎng)皿底部剝離
將細胞懸浮液轉(zhuǎn)移到 15 mL Falcon 管中,在 22℃–25℃之間以 200 xg 離心 3 分鐘,使細胞沉淀
吸出上清液并將細胞沉淀物重懸在 1 mL 新鮮生長培養(yǎng)基中
將四分之一的細胞懸浮液接種到一個新的 10 厘米培養(yǎng)皿中,并添加額外的8 毫升新鮮生長培養(yǎng)基
培養(yǎng)細胞直至其達到轉(zhuǎn)染所需的最佳細胞密度
細胞轉(zhuǎn)染
時間:60-120分鐘
將AARS1/2 siRNA、AARS1/2質(zhì)粒或?qū)φ召|(zhì)粒單獨或組合轉(zhuǎn)染至HEK293T細胞中。每次處理應(yīng)至少準備兩個10 cm細胞培養(yǎng)皿,以提供足夠的蛋白質(zhì)用于乳酰肽的富集。在本方案中,我們使用聚乙烯亞胺(PEI)轉(zhuǎn)染AARS1/2構(gòu)建體或?qū)φ召|(zhì)粒,并使用脂質(zhì)體轉(zhuǎn)染siRNA。轉(zhuǎn)染所需的siRNA、DNA構(gòu)建體和轉(zhuǎn)染試劑用量見下面。
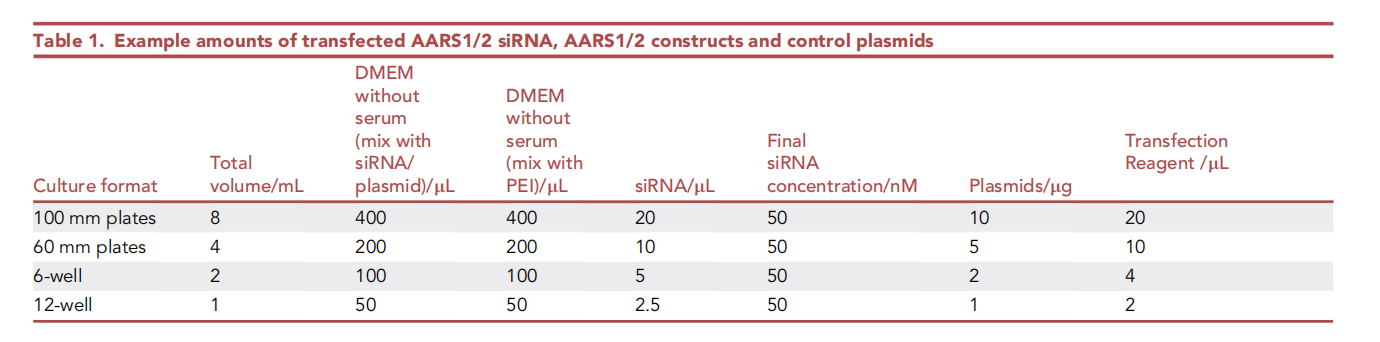
10、轉(zhuǎn)染前培養(yǎng)細胞直至其達到 40%–50% 細胞密度
11、使用不含血清的 DMEM 培養(yǎng)基稀釋表中所示適量的 siRNA 或質(zhì)粒
注意:siRNA 應(yīng)懸浮于無 RNase 的水中,并以 20–100 mM 的濃度儲存
使用無血清的 DMEM 培養(yǎng)基,按照表中所示稀釋適量的脂質(zhì)體轉(zhuǎn)染試劑或PEI,將其與稀釋的 siRNA 或質(zhì)粒混合,室溫孵育 20 分鐘
將DNA混合物逐滴加入相應(yīng)的培養(yǎng)皿中
將轉(zhuǎn)染后的細胞置于37℃、5%二氧化碳的培養(yǎng)箱中孵育6小時
吸出培養(yǎng)基,更換為新鮮的DMEM培養(yǎng)基
注意:在所有siRNA實驗中,必須設(shè)置對照組以評估靶向基因敲低的效果
乳酸刺激
時間:1天
為了更全面地比較不同實驗中蛋白質(zhì)乳酸化水平的變化,除了常規(guī)培養(yǎng)的細胞外,我們還建立了一個平行組,在該組中,乳酸被添加到細胞培養(yǎng)基中,以提高乳酸化的水平。
更換為新鮮的DMEM培養(yǎng)基后,將乳酸溶液以25 mM的最終濃度加入培養(yǎng)基中
在培養(yǎng)箱中繼續(xù)孵育細胞24-36小時
細胞收獲和裂解
耗時:2小時
小心地從細胞中吸出培養(yǎng)基
每次添加 2 mL 冰冷 PBS 沖洗細胞兩次
加入 1 mL PBS 并吹打直至所有細胞脫離培養(yǎng)皿底部,從而分離細胞。將細胞收集到新的 1.5 mL Eppendorf 管中
注意:如果細胞粘附過度,無法通過移液器將其從培養(yǎng)皿底部取下,請使用細胞刮刀將細胞分離
在 4℃ ,900 x g 離心 10 分鐘,沉淀細胞
吸出上清液。
注意:如果您計劃進行 SILAC 實驗,請在此步驟中計數(shù)細胞并混合等量的重同位素標記細胞和對照細胞
用 500 mL denaturing lysis buffer重懸細胞沉淀
使用ultrasonic Horn進行超聲處理以降低細胞裂解物粘度(共 2 分鐘;脈沖模式:開啟 2 秒,關(guān)閉 2 秒;幅度設(shè)置為 35%)
注意:
應(yīng)根據(jù)蛋白質(zhì)的量和蛋白質(zhì)溶液的體積來選擇超聲的尺寸和超聲波處理的持續(xù)時間
使用冰浴以防止超聲處理過程中蛋白質(zhì)降解
將樣品在 4°C 下以 13000 x g 的速度離心 15 分鐘,以去除不溶性物質(zhì)。將上清液收集到一個新的 1.5 mL Eppendorf 管中
蛋白質(zhì)消化
耗時:0.5天
使用 BCA 分析法確定細胞裂解物的蛋白質(zhì)濃度,并分離 2 mg 蛋白質(zhì)進行消化
注意:BCA 檢測的標準曲線應(yīng)覆蓋樣品預(yù)期濃度的整個范圍。每次檢測樣品都需要建立標準曲線
27.沉淀蛋白質(zhì)
A、用 100 mM Tris-HCl、pH 8.5 將裂解物溶液稀釋至 4 M 尿素
關(guān)鍵:濃度為 8 M 時,添加丙酮后尿素會沉淀出來,影響蛋白質(zhì)的消化效率
B、將冰冷的丙酮添加到裂解物溶液中,并在 -20℃ 下孵育混合物 30 分鐘,使用體積為裂解物溶液六倍
C、在 4℃ 下以 13000 x g 離心 30 分鐘,使沉淀的蛋白質(zhì)沉淀下來。
暫停點:樣品可以在-80℃的溫度下在此點保存長達1個月
28.用 Lys-C 消化
A、用 500 μL 50 mM ABC 緩沖液重新懸浮蛋白質(zhì)沉淀
注意:50 mM ABC 緩沖液的 pH 應(yīng)為 8.0。如果 pH 值偏差過大,請準備新的緩沖液
B、將 Lys-C 添加到裂解物中,最終濃度為 10 ng/μL
C、 37℃ 下孵育 3-4 小時。
關(guān)鍵:將蛋白質(zhì)顆粒懸浮在轉(zhuǎn)速設(shè)為 1500 rpm 的培養(yǎng)搖床上
29.用胰蛋白酶消化
A、以 1:100 的酶與底物比例將胰蛋白酶添加到反應(yīng)混合物中
B、在 37℃ 下孵育 12 小時
30.肽還原和烷基化
A、將 5 μL 1 M TCEP 緩沖液加入蛋白消化液中,充分混勻,25℃ 孵育 15 分鐘
B、將 10 μL 500 mM IAA 緩沖液加入蛋白消化液中。混勻,25℃避光孵育 20 分鐘
關(guān)鍵:IAA 對光不穩(wěn)定,烷基化應(yīng)在黑暗中進行。
通過添加 TFA 至最終濃度為 1% 來終止消化
在室溫下以 13000 x g 的速度離心樣品 5 分鐘,以去除不溶性物質(zhì)
將上清液轉(zhuǎn)移到新的 5 mL Eppendorf 管中進行肽脫鹽
肽脫鹽
耗時:0.5天
文中使用reverse-phase Strata-X 33 mm Polymeric sorbent solid-phase extraction cartridges 柱體尺寸的選擇應(yīng)基于消化蛋白的量,約為填料重量的 10% (wt/wt)。
34.用 1 mL 脫鹽活化緩沖液cartridges
關(guān)鍵:洗脫步驟前請勿排空濾芯。每個步驟結(jié)束時,濾芯上方應(yīng)保留一層液體。
35.使用 2 mL SPE 平衡緩沖液平衡cartridges
36.裝入收集的肽溶液。
注意:樣品通過后,catridges可能會變黃,這表明已經(jīng)進行了還原和烷基化。
37.用 2 mL SPE 平衡緩沖液清洗。
38.用 1 mL SPE 洗脫緩沖液洗脫,并將洗脫液收集到新的 1.5 mL Eppendorf 管中
39.分離 50 μL 洗脫液(100 μg 細胞裂解液肽)并用離心機干燥
注意:分離的肽將用于蛋白質(zhì)組分析
40.用液氮冷凍洗脫液,然后將其凍干
關(guān)鍵:
凍干,并去除樣品中的所有殘留酸,以便進行下一步的乳肽富集步驟
凍干粉應(yīng)呈黃白色蓬松狀。如果無法凍干,請使用 SpeedVac 離心機干燥洗脫液
暫停點:樣品可以在-80℃的溫度下在此點保存長達1個月
乳酸化肽段富集
耗時:0.25天
使用抗L-乳酰賴氨酸抗體偶聯(lián)瓊脂糖珠(可使用斯達特Anti-L-lactyllysine?agarose?Beads替代,貨號:S0F0003,用量可根據(jù)說明書及樣本情況進行調(diào)節(jié))。珠子的用量應(yīng)根據(jù)消化的蛋白質(zhì)量確定。在本方案中,每2 mg蛋白質(zhì)消化物建議使用10 μL抗L-乳酰賴氨酸抗體偶聯(lián)瓊脂糖珠(圖1)。在每個步驟中,使用微量離心機在4℃下以1000 x g離心1分鐘,使珠子沉淀
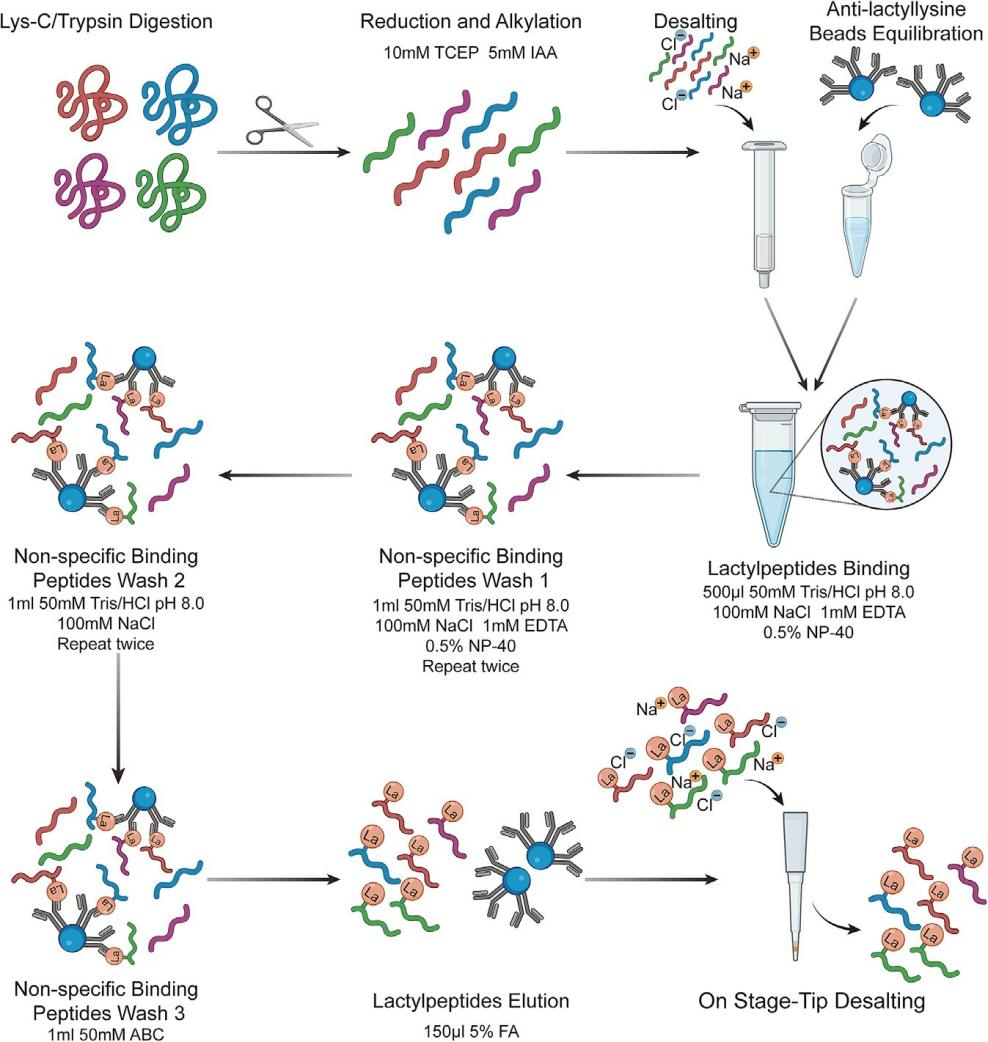
圖 1 利用 Anti-L-lactyllysine?agarose?Beads富集乳酰肽的示意圖
注意:在正式實驗前,研究人員應(yīng)應(yīng)用HeLa細胞裂解物等標準品進行預(yù)實驗,確保抗L-乳酰賴氨酸抗體偶聯(lián)瓊脂糖珠的富集效率在不同批次和供應(yīng)商之間保持一致
41.將凍干肽重懸于1 mL乳酰肽binding buffer中。渦旋或超聲處理是確保肽溶解的必要措施
注意:在肽富集之前檢查溶液的pH值。pH值應(yīng)約為8.0
在 4℃ 下以 13000 x g 離心 10 分鐘,使溶液澄清
吸取10 μL Anti-L-lactyllysine?agarose?Beads,用1 mL乳酰肽binding buffer清洗微珠。離心使微珠沉淀
將澄清的肽溶液轉(zhuǎn)移到含有Anti-L-lactyllysine?agarose?Beads的管中,并在 4℃ 下旋轉(zhuǎn)孵育 4 小時
注意:為確保乳酸化肽的富集效率,孵育時間應(yīng)不少于4小時。不建議過夜孵育,因為過夜孵育會導致更多的非特異性結(jié)合
45.通過離心將Beads沉淀下來
注意:收集上清液作為備用,以防乳肽富集失敗。上清液可在-80℃保存長達1個月
46.用 1 mL lactylpeptide binding buffer在 4℃ 下旋轉(zhuǎn)清洗珠子兩次,每次 10 分鐘
47.用 1 mL lactylpeptide wash buffer 4℃下旋轉(zhuǎn)洗滌珠子兩次,每次 10 分鐘
48.在 4℃ 下旋轉(zhuǎn),用 1 mL 50 mM ammonium bicarbonate buffer進行最后清洗 10 分鐘
49.從珠子中洗脫乳酸化肽段
用 100 μL 1% TFA 重懸珠子,室溫放置 10 分鐘。離心使珠子沉淀,將上清液收集到新的 1.5 mL Eppendorf 管中
用 50 μL 1% TFA 重懸珠子,旋轉(zhuǎn)孵育 10 分鐘。離心使珠子沉淀,將上清液與第一次洗脫液合并。
注意:可使用 0.22 mm 過濾器過濾溶液以去除殘留珠子
Stage-tip 脫鹽
時間:2 小時
乳酰肽洗脫液需要使用 C18 Stage-tip 進行凈化,以進行質(zhì)譜分析。在本方案中,我們采用 Empore C18 固相萃取盤 (2215-C18) 來進行Stage-tip。
注意:應(yīng)根據(jù)您的階段吸頭調(diào)整離心速度,并確保溶劑流速保持在 5 μL /min
用 20 μL 脫鹽活化緩沖液調(diào)節(jié)Stage-tip
用 20 μL Stage-tip脫鹽緩沖液 B 清洗階段吸頭
用 20 μL Stage-tip脫鹽緩沖液 A 平衡階段吸頭
使乳酸化肽洗脫液通過Stage-tip
用 20 μL Stage tip 脫鹽緩沖液 A 對樣品進行脫鹽
將 Stage-tip 轉(zhuǎn)移至新的 Eppendorf 管中
用 20 μL Stage-tip 脫鹽緩沖液 C 洗脫肽。收集流穿液
用 20 μL Stage-tip 脫鹽緩沖液 B 洗脫肽。將流穿液與第一次洗脫的流穿液合并
在 SpeedVac 離心機中干燥洗脫液
暫停點:此時樣品可在 -80℃ 下保存長達 1 周
LC-MS 分析
時間:數(shù)周
作者描述了 Orbitrap Exploris 480 與 Easy-nLC 1200 系統(tǒng)的聯(lián)用設(shè)置
59.準備 LC-MS/MS 設(shè)備
A、安裝足量的新鮮流動相溶劑 A 和溶劑 B。需要對溶劑 A 和 B 進行超聲處理以清除氣泡
B、用流動相緩沖液沖洗泵 A、泵 B 和泵 S 中的空氣。沖洗閾值為 10 μL
C、用 10 μL 的 90% 溶劑 B 緩沖液激活分析柱
D、通過運行空白樣品平衡分析柱。確保流動相流路順暢
注意:安裝流動相溶劑、沖洗空氣和激活分析柱可能需要 1小時。運行空白樣品可能需要 30 分鐘
60.制備 Klac 富集樣品
A、將富集的 Klac 肽溶解于 5 μL 0.1% 甲酸(溶劑 A)中
B、 4oC 下以 12,000x g 離心 20 分鐘以去除不溶性物質(zhì)。
C、將 4.5 μL 上清液轉(zhuǎn)移到自動進樣器小瓶中
D、將 4 μL 樣品裝入 Easy-nLC 1200 HPLC
制備蛋白質(zhì)組樣品。
A、用 20 μL 0.1% 甲酸(溶劑 A)溶解步驟 39 中分離的肽
B、在 4oC 下以 12,000x g 離心 20 分鐘以去除不溶性物質(zhì)
C、將 18 μL 上清液轉(zhuǎn)移到自動進樣器小瓶中
D、將 1 μL 樣品裝入 Easy-nLC 1200 HPLC 中
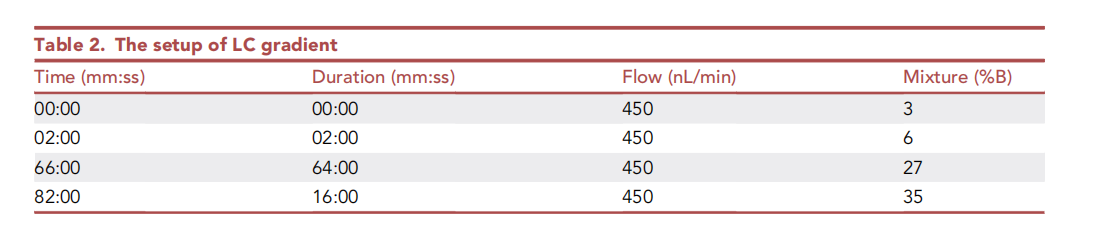
LC 梯度設(shè)置如下圖所示
63、MS 參數(shù)
使用以下參數(shù)設(shè)置 Orbitrap Exploris 480 的質(zhì)譜方法
A、正離子模式
B、噴霧電壓為 2.0 kV
注意:如果Steel emitter有污漬或磨損,導致噴霧不穩(wěn)定,請將噴霧電壓增加到 2.1 kV
加熱毛細管溫度為 320oC
將全 MS 分辨率設(shè)置為 60,000,最大注射時間為 25ms
將 MS1 質(zhì)量范圍設(shè)置為 350–1400,AGC 目標設(shè)置為 1e6
使用 Top20 方法將 HCD 碎片譜圖分辨率設(shè)置為 15,000,最大進樣時間為 22 毫秒
將 MS2 質(zhì)量范圍設(shè)置為 200–1400 m/z,AGC 目標設(shè)置為 5e4
將最大進樣時間為 45 ms
將隔離窗口設(shè)置為 6 m/z,標準化碰撞能量設(shè)置為 27%。
數(shù)據(jù)處理
時間:0.5 天
概述了使用 MaxQuant 處理原始文件的方法。我們提供了設(shè)置新修改的詳細步驟以及無標記定量的參數(shù)。在本方案中,作者使用 MaxQuant(版本 2.0.3.0),并在 UniProtKB 人類完整蛋白質(zhì)組序列數(shù)據(jù)庫中搜索所有獲取的原始文件。請參閱圖 2,了解 MaxQuant 用于分析這些數(shù)據(jù)的詳細參數(shù)工作流程。其他軟件,例如 Proteome Discoverer、pQuant 和 MSFragger,也可用于處理質(zhì)譜原始文件和進行非標記定量分析。
注意:賴氨酸的乳酸化會阻止胰蛋白酶消化賴氨酸 C 端。因此,我們建議在“乳酸化 (K)"中選擇“非 C 端"。
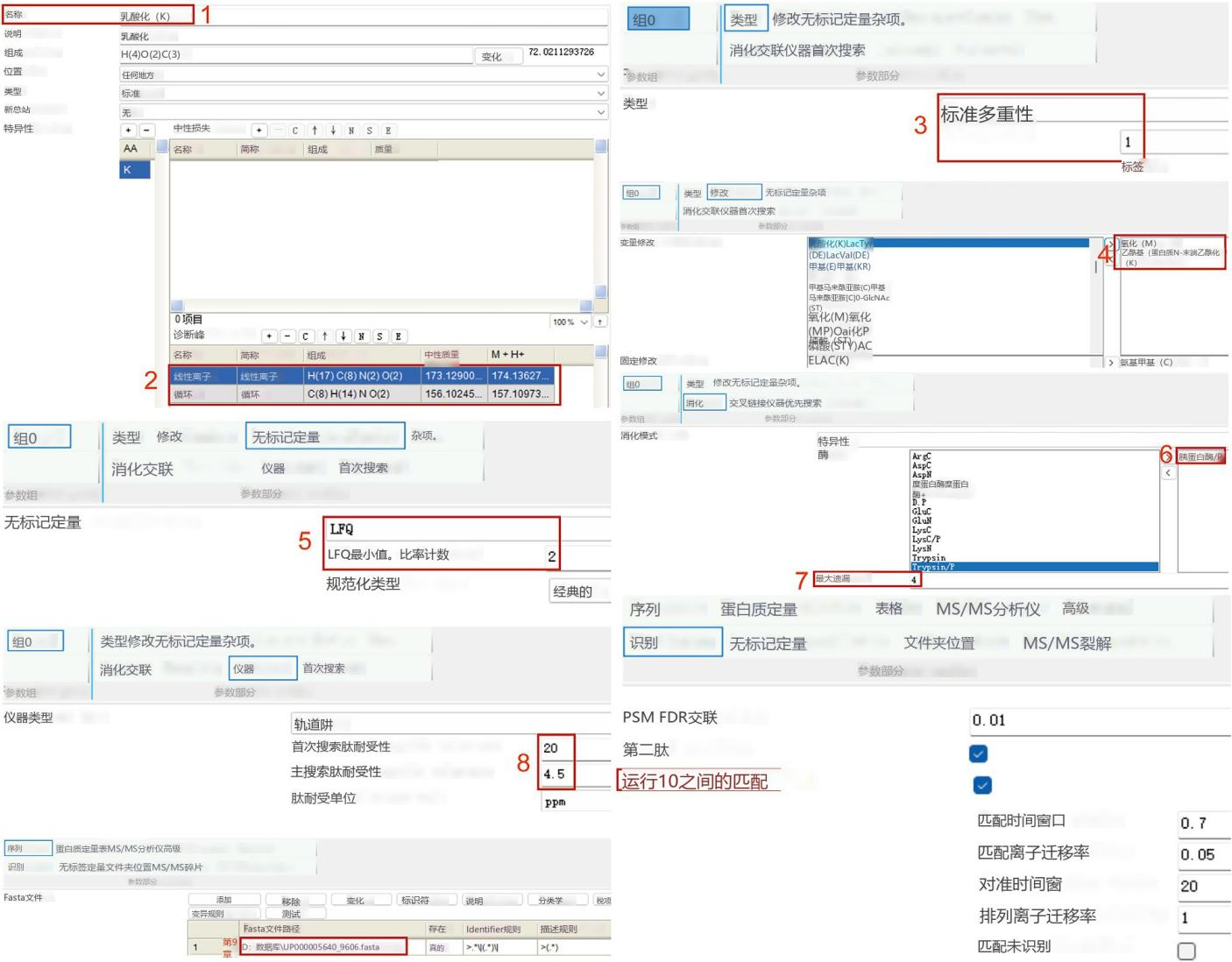
圖 2 配置 MaxQuant 參數(shù)以鑒定和定量乳酰肽
預(yù)期結(jié)果
在本方案中,作者執(zhí)行了一個工作流程來高效富集乳酰賴氨酸肽。基于質(zhì)譜分析,可以全面分析乳酰賴氨酸修飾,并量化對照細胞、AARS1/2 敲低細胞和 AARS1/2 過表達細胞中的修飾水平。下表顯示了使用本方案中描述的工作流程在指定細胞中鑒定出的乳酰賴氨酸修飾位點數(shù)量。此外,圖 3 和圖 4 展示了熱圖,描繪了各組乳酰賴氨酸修飾的差異。


圖 3 熱圖顯示對照、AARS1 和/或 AARS2 耗盡 (si-AARS1/si-AARS2) HEK293T 細胞中整體賴氨酸乳酸組的顏色編碼強度水平,用 PBS (Lac ''-'') 或 L-乳酸 (Lac ''+'') 處理 24 小時

圖 4. 熱圖顯示了在用對照(AARS1-/AARS2 -)或 AARS1/AARS2 表達質(zhì)粒(AARS1 +/ AARS2 +)轉(zhuǎn)染的 HeLa 細胞中,整體賴氨酸乳酰化的顏色編碼強度水平
斯達特乳酸化相關(guān)抗體
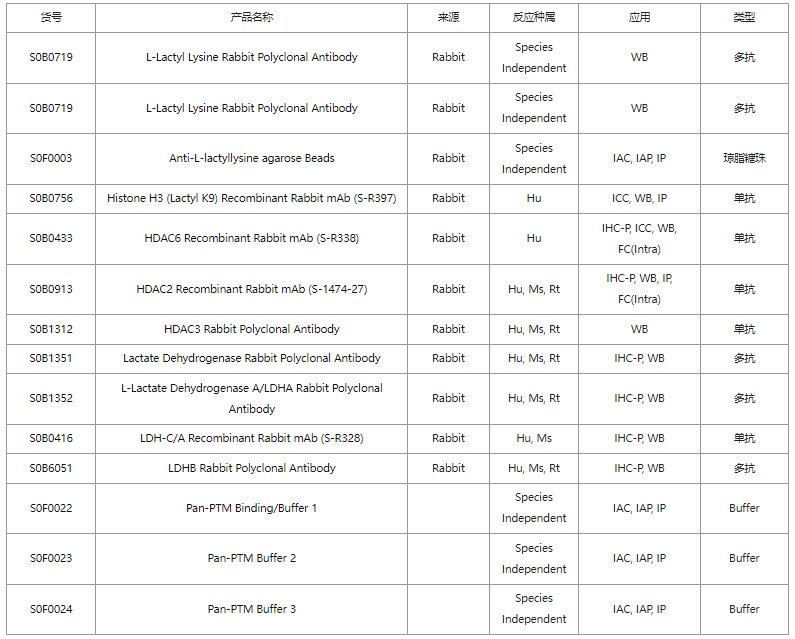
杭州斯達特 志在為全球生命科學行業(yè)提供優(yōu)質(zhì)的抗體、蛋白、試劑盒等產(chǎn)品及研發(fā)服務(wù)。依托多個開發(fā)平臺:重組兔單抗、重組鼠單抗、快速鼠單抗、重組蛋白開發(fā)平臺(E.coli,CHO,HEK293,InsectCells),已正式通過歐盟98/79/EC認證、ISO9001認證、ISO13485。
Cell Star Protocol 重磅解析: 無標簽定量賴氨酸乳酸化蛋白組分析方案
關(guān)注公眾號

Copyright © 2025杭州斯達特生物科技有限公司 All Rights Reserved 工信部備案號:
技術(shù)支持:化工儀器網(wǎng) 管理登錄 sitemap.xml