
技術文章
 更新時間:2025-11-14
更新時間:2025-11-14 點擊次數:105
點擊次數:105
水泡性口炎病毒(Vesicular Stomatitis Virus, VSV)的G蛋白是病毒入侵宿主細胞的核心分子,其跨膜區(Transmembrane Domain, TM)的缺失版本——VSV G (ΔTM)蛋白,近年來因獨特的生物學特性成為基因遞送、病毒載體改造及結構生物學研究的熱點。本文將從結構特征、功能機制、應用場景及最新研究進展四個維度,系統解析這一關鍵蛋白的分子密碼。
一、結構特征:從完整G蛋白到ΔTM的精簡設計
1,完整G蛋白的三維構象
完整VSV G蛋白由511個氨基酸組成,包含三個功能域:
胞質尾區(C-terminal Cytoplasmic Tail):C端1-29個氨基酸為親水區,伸向病毒包膜內側;30-49位為20個氨基酸的疏水跨膜區(TM),錨定病毒包膜;
胞外區(Ectodomain):跨膜區延伸至N端的462個殘基形成病毒包膜表面的三聚體突起,含兩個N-糖基化位點(Asn178和Asn335),糖鏈占分子量的10%,由宿主細胞內質網和高爾基體加工形成復雜寡糖結構;
信號肽(Signal Peptide):N端16個氨基酸的疏水序列介導蛋白插入內質網膜后被切割。
2,ΔTM蛋白的工程化改造
VSV G (ΔTM)蛋白通過基因編輯技術刪除完整的跨膜區(通常保留C端1-29個氨基酸的胞質尾區),僅保留胞外區。這一改造帶來兩大優勢:
可溶性表達:缺失跨膜區后,蛋白可分泌至細胞外基質或培養基中,便于純化;
功能模塊化:胞外區保留受體結合、pH依賴性構象變化及膜融合的核心功能,同時避免跨膜區可能引發的非特異性相互作用。
二、應用場景:從基礎研究到臨床轉化的多維度突破
1.基因治療載體優化
逆轉錄假基因:通過與VSV G (ΔTM)重組,含綠色熒光蛋白(GFP)的逆轉錄病毒滴度提升10倍以上,感染效率顯著增強;
腫瘤靶向改造:突變ΔTM蛋白的膜結合域可降低病毒神經毒性,同時通過抗體偶聯實現腫瘤特異性遞送。
2.疫苗開發平臺
VSV基疫苗載體:刪除VSV基因組中的G蛋白基因,代之以外源抗原基因,利用ΔTM蛋白的包裝系統生成重組病毒樣顆粒(VLP),已用于埃博拉病毒、HIV等疫苗研發;
亞單位疫苗:純化的ΔTM蛋白可作為免疫原,誘導針對G蛋白的中和抗體應答。
3.結構生物學研究工具
冷凍電鏡(Cryo-ET)模型:周正洪團隊利用ΔTM蛋白捕捉到G蛋白膜融合的四大中間構象(彎折型、扭曲型、伸展型、Y型),揭示了融合環插入宿主膜的動態機制;
pH傳感器開發:基于G蛋白的pH依賴性構象變化,設計可實時監測內吞體酸化的熒光探針。
三、最新研究進展:從機制解析到技術革新
1.膜融合機制的深化
2024年《Science Advances》研究證實,VSV G (ΔTM)蛋白在酸化條件下依次經歷四大中間構象,其中Y型中間體占比在孵育早期達60%,提示其為融合啟動的關鍵狀態;伸展型中間體隨時間推移占比升至40%,與融合后期作用一致。
2.跨膜區功能的再審視
盡管ΔTM蛋白缺失跨膜區,但研究發現:
機械力傳導:完整G蛋白的TM區通過疏水相互作用對膜施加機械力,促進融合孔擴張;
序列依賴性:替換TM區特定氨基酸(如Leu45、Ile48)可阻斷融合功能,表明TM區存在融合相關關鍵殘基。
3.抗病物靶點
基于ΔTM蛋白的結構研究,科學家提出兩大干預策略:
阻斷中間構象:設計小分子抑制劑穩定Y型中間體,防止其向伸展型轉化;
干擾糖基化:抑制N-糖基化位點(Asn178/Asn335)的加工,降低G蛋白的穩定性和融合活性。
結語:從病毒到生物工具的華麗轉身
VSV G (ΔTM)蛋白的研發歷程,是基礎科學與轉化醫學深度融合的范本。從病毒入侵的“鑰匙"到基因治療的“載體",從結構生物學的“模型"到抗病藥物的“靶點",這一精簡設計的蛋白分子持續推動著生命科學邊界的拓展。未來,隨著單分子技術、AI蛋白質設計等前沿技術的融合,VSV G (ΔTM)蛋白有望在精準醫學、合成生物學等領域綻放更璀璨的光芒。
相關產品推薦:
貨號 | 產品名稱 | 表達宿主 |
UA030092 | VSV G (ΔTM) His Tag Protein | CHO |
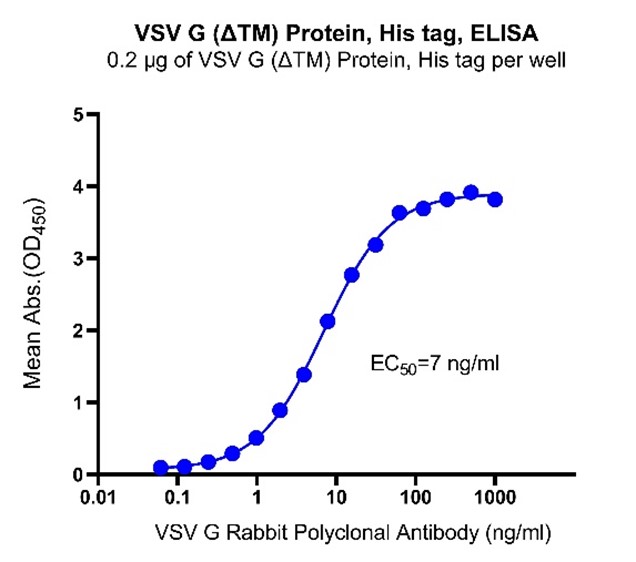
ELISA活性數據:
Immobilized VSV G (ΔTM) Protein, His tag at 2 μg/mL (100 μL/well) can bind VSV G Rabbit Polyclonal Antibody (Cat. No. S0B6146) with EC50 of 6.5-7.4 ng/ml.
電泳(SDS-PAGE):
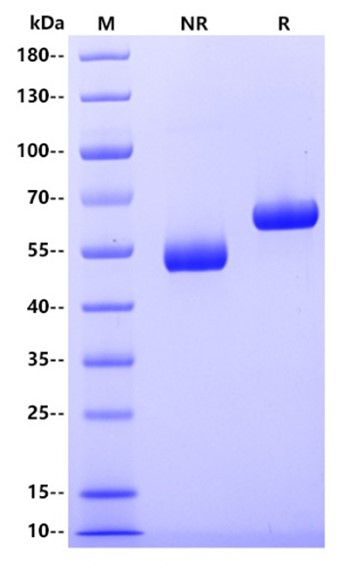
>95% by SDS-PAGE